手性作为自然界的一种普遍属性,不仅广泛存在于DNA、蛋白质等生物手性分子中,也在人工构建的超分子体系中得到精确复现与运用。其特有的不对称结构深刻关联并精密调控着诸多光物理及生物化学过程,尤其在提升三重态生成效率方面具有重要意义。高效的三重态生成对光动力治疗、室温磷光材料及手性发光器件等前沿领域具有核心应用价值。然而,手性如何精确影响并促进分子从单重态向三重态的系间窜越过程,其动态机制尚不清晰。核心挑战在于,系间窜越是发生在皮秒至纳秒尺度的超快事件,而手性效应在激发态亦随之动态演化,常规光谱技术难以捕获这两个超快过程之间的实时关联与耦合规律。
近期,华东师范大学精密光谱科学与技术国家重点实验室、精密光谱科学与技术高等研究院陈缙泉教授、梅晔研究员、王雪力副研究员团队联合发展并融合了飞秒时间分辨圆偏振发光光谱与瞬态吸收光谱技术,在国际上首次实现了对激发态手性演化与三重态生成动力学的同步、实时观测。研究以天然抗生素褐黄癌菌素V(GV)为模型,将其插入具有标准右手螺旋的B型DNA双链中,构建了明确的手性调控体系。实验发现,GV的三重态量子产率从溶液中的7.6%显著提升至DNA环境中的25.8%。通过自主研发的飞秒时间分辨圆偏振发光光谱,研究团队直接捕捉到了GV在DNA中激发态手性的动态演化轨迹。这一演化过程与瞬态吸收光谱观测到的三重态生成动力学高度同步,清晰揭示出两条由激发态手性驱动的系间窜越通道。进一步的量子化学计算阐明了手性增强的微观物理机制。DNA的螺旋手性环境不仅使GV分子的磁跃迁偶极矩增强了十倍以上,同时显著缩小了关键的单重态-三重态能级间隙,二者协同作用大幅增强了自旋-轨道耦合强度,从而有效促进了系间窜越速率。该工作首次在超快时间尺度上建立了“手性演化”与“三重态生成”之间的动态关系,为理解手性调控光物理过程提供了直接的实验证据。
该研究不仅从机制层面深化了对分子激发态手性行为的科学认知,也为基于理性手性组装策略,设计新一代高效三重态光敏剂、长寿命发光材料及手性光电器件提供了重要的理论依据和创新设计思路。研究成果以“Chirality Enhanced Triplet-State Generation in a DNA-Intercalated Natural Antibiotic”为题,于2025年11月发表于化学领域顶级期刊Journal of the American Chemical Society。
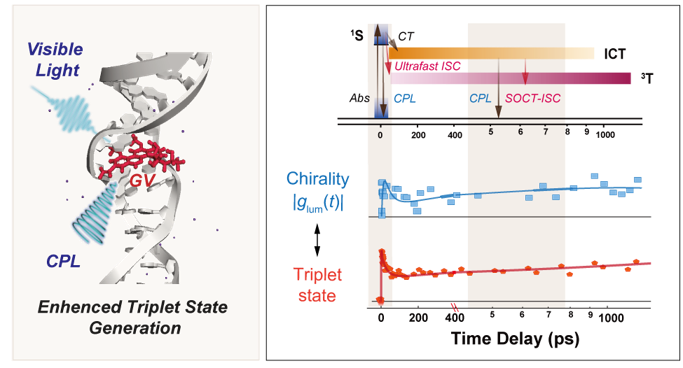
图1: (左)GV嵌入B-DNA的分子结构示意图。(右)实验测得激发态手性与三重态生成动力学关联图
论文原文链接: