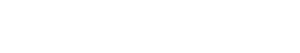光学显微镜作为一种重要工具,将人类的视野拓展到微观尺度,能够观测细胞内部结构和生化过程,极大地促进了生物、医学等领域的发展。然而由于光学衍射极限的限制,常规光学显微镜的空间分辨率只能达到200 nm,难以观测亚细胞器尺度的精细结构。为了打破光学衍射极限的障碍,研究人员已发展出多种超分辨显微技术。比如,受激辐射损耗显微技术(STED)将荧光分子的受激辐射损耗与扫描共焦显微镜相结合,通过抑制环形区域荧光发射同时保留中心区域激发的方式使得有效荧光区域最小化,在生物样品中获得了20 nm的分辨率。但是点扫描的成像方式降低了整体的成像速度,同时受激辐射损耗所需的高激光功率加剧了样品的光漂白和光损伤。单分子定位显微技术(SMLM)通过单分子定位提取荧光分子的位置而不是荧光的强度分布来规避光学衍射极限,能够获得高达10 nm的分辨率。但是单分子定位显微需要拍摄近千张稀疏分布的荧光图像才能提取出一张超分辨图片,成像速度非常慢。结构光照明显微技术(SIM)利用一系列结构光模式照明样品,将样品图像的高频信息通过莫尔效应转换到低频部分,再通过对频谱的分离和重组获得超分辨图像。相较于前两种超分辨显微技术,SIM具有超分辨成像速度快、激发功率低和对荧光材料无特殊要求的优点,在活体细胞动态超分辨观测上得到了广泛的应用。然而,SIM仍然需要采集多帧图片来重构单张超分辨图像,成像速度受限于相机采样速度。
为了突破SIM的成像速度限制,张诗按课题组提出了一种压缩成像型结构光照明超分辨显微方案(CISIM),将压缩感知原理与结构光照明相结合,获得了近两个数量级的超分辨成像速度提升。 CISIM系统依次进行结构光照明、高速空间编码和时空叠加图像采集,将待测动态场景压缩至单张图像,并利用图像重构算法从其中还原出连续的超分辨图像序列。CISIM通过这种方式,克服了相机拍摄速度的硬件限制,显著提升了超分辨成像速度。仿真实验验证了CISIM的超分辨能力,并对图像压缩比以及图像噪声对重构图像质量的影响进行了分析。
该工作为诸如神经元放电、有丝分裂动力学等超高速亚细胞器尺度过程的精细观测提供了一种重要工具。此外这种压缩成像的策略还可进一步应用于三维结构光照明显微技术,提升其成像速度。该工作发表于Opt. Express 30, 14287 (2022)。
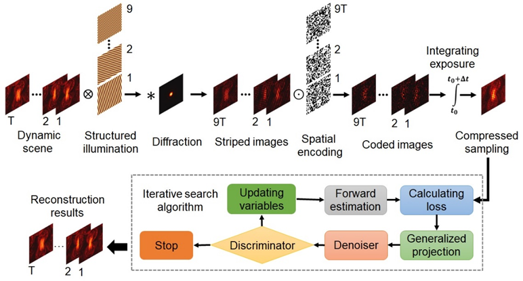
图1:压缩成像型结构光照明显微技术原理。
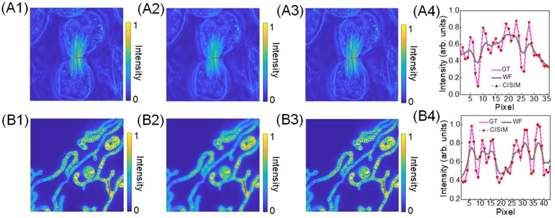
图2:压缩成像型结构光照明显微的图像仿真重构结果。A1、 B1分别是用于仿真的昆虫精母细胞减数分裂和线粒体内嵴运动过程的一帧真实图像, A2、B2分别是相应宽场显微图像,A3、B3分别是相应压缩成像型结构光照明显微重构图像,A4、B4分别是相应选择区域的强度分布对比。根据实验结果,CISIM能够获得超出宽场显微的超分辨效果。